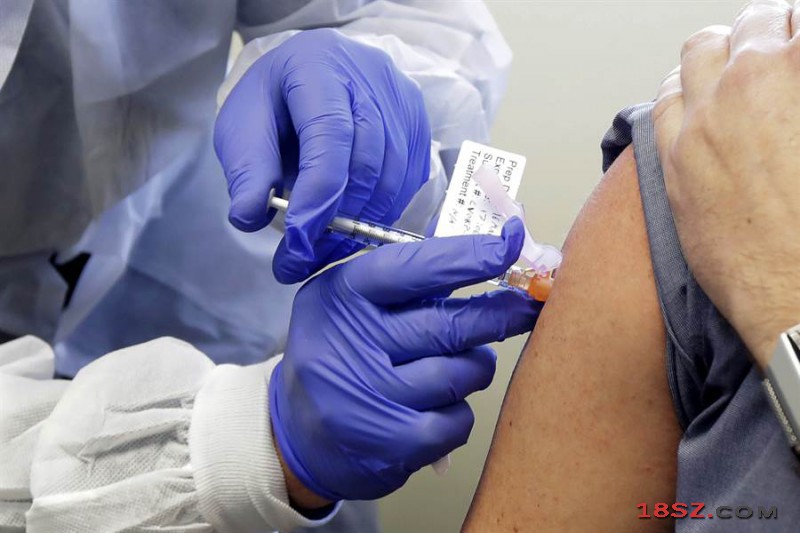
美FDA接受Inovio制药首款DNA候选疫苗临床试验申请,已获准开始进行临床试验,试验结果将于夏末公布,争取在年进行量产。图为3月中一批志愿者接受不同类型新冠疫苗临床试验。(图/美联社)
美国食品药品监督管理局(FDA)宣布受理一项新冠病毒疫苗进入临床试验申请,是由Inovio Pharmaceuticals公司所研发的新冠病毒候选DNA疫苗INO-4800。这是全球第3款进入临床试验阶段的新冠病毒疫苗,也是首个DNA候选疫苗,首批试验结果预计于今年夏末公布,争取2020年底实现量产。
据《澎湃新闻》报导,INO-4800是全球首个进入临床试验阶段的新冠病毒DNA候选疫苗。在此之前,另有两款疫苗进入了临床试验阶段,分别是大陆解放军军事科学院科学团队与康希诺公司联合研发的腺病毒载体疫苗,以及美国国家卫生院(NIH)资助的生物科技公司Moderna Therapeutics研发的mRNA疫苗。
Inovio Pharmaceuticals公司计画本周启动1期临床试验,第一名志愿者计画在4月接种疫苗。1期INO-4800研究将在宾夕法尼亚大学佩雷尔曼医学院和密苏里州坎萨斯城药物研究中心招募40名健康的成人志愿者,每名参与者将在相隔4周的时间内接受两剂INO-4800,此项研究的初始免疫反应和安全性资料预计将在今年夏末公布。
报导说,INO-4800的临床前研究表明,该疫苗在针对多种动物的试验中取得了令人满意的免疫反应结果,这些资料已与全球监管机构共用。包括挑战性研究在内的其他临床前试验,将继续与1期临床试验同时开展。
INOVIO的新冠疫苗前期研究指出,它与INOVIO完成的1期中东呼吸综合征(MERS)疫苗研究结果保持一致,MERS也是由冠状病毒引起的,在MERS疫苗研究中,INOVIO的DNA疫苗在95%的受试者身上产生了良好的耐受性,并诱导出高水准的抗体反应,同时在近90%的研究参与者身上产生了广泛的T细胞反应。在给药后的60周内,该试验中使用的DNA疫苗(INO-4700)在受试者身上保持了持久的抗体反应。
这次进行新冠疫苗临床试验的Inovio Pharmaceuticals公司获得比尔及梅琳达.盖兹基金会(Bill & Melinda Gates Foundation)资助的500万美元,INO-4800另外还获得流行病防范创新联盟(CEPI)高达900万美元的资金支持。
Inovio Pharmaceuticals也是流行病防范创新联盟宣布的三个合作伙伴之一。该公司的主要任务是利用其DNA药物平臺快速开展新型流行病毒疫苗研发的工作,目前正尽力争取在2020年底实现INO-4800的大规模生产。

 Iteca Exhibitions
Iteca Exhibitions 长城润滑油
长城润滑油 German Machine Tool Builders Association
German Machine Tool Builders Association 延长石油
延长石油 3M制造业
3M制造业 陕煤化工集团
陕煤化工集团 HUAWEI
HUAWEI Dahua Technology
Dahua Technology 中国石油
中国石油 Gemtique
Gemtique KUNVII
KUNVII IAA Show
IAA Show PALEXPO
PALEXPO LASTON
LASTON 中杭贸易
中杭贸易 Etek Europe
Etek Europe PV EXPO
PV EXPO 陕西有色金属
陕西有色金属 QIIE青岛进博会
QIIE青岛进博会 维远光伏产业
维远光伏产业 Time Out Group
Time Out Group IFEMA
IFEMA 天元化工
天元化工 National Media
National Media 吉祥星科技
吉祥星科技 Dowpol Chemical
Dowpol Chemical 海康威视-HIK VISION
海康威视-HIK VISION Hannover Messe
Hannover Messe TOSHIBA
TOSHIBA Productronica
Productronica HealthCare
HealthCare 深圳会展中心
深圳会展中心 大唐旗舰店
大唐旗舰店 Soul Game
Soul Game 神木职教中心
神木职教中心 Sinopec
Sinopec 深美闳约_宝能第一空间名家书画联展开幕现场
深美闳约_宝能第一空间名家书画联展开幕现场 外滩漫步-上海不夜的精彩
外滩漫步-上海不夜的精彩 冬季入浴前需提前预热浴室
冬季入浴前需提前预热浴室 2019十大考古新发现推介:山东滕州西孟庄遗址
2019十大考古新发现推介:山东滕州西孟庄遗址 2021圣诞前夕宝能第一空间崔培鲁画展
2021圣诞前夕宝能第一空间崔培鲁画展 Bearing Show In Essen
Bearing Show In Essen 崔培鲁北京工作室创作展示
崔培鲁北京工作室创作展示 伦敦国际军工及技术展览会( ITEC)
伦敦国际军工及技术展览会( ITEC) 欧洲央行官员呼吁加强非银行金融部门监管
欧洲央行官员呼吁加强非银行金融部门监管 不开放的北齐墓葬壁画乘「云」露真容
不开放的北齐墓葬壁画乘「云」露真容 空旷的纽约公园大道
空旷的纽约公园大道 山广两东皆为家
山广两东皆为家 湾仔「年轮」——海岸线嬗变的光阴故事
湾仔「年轮」——海岸线嬗变的光阴故事 花卉纹彩陶瓮
花卉纹彩陶瓮 崔氏国画-雄鸡
崔氏国画-雄鸡 2019年科隆古董古物艺术品交易展览会
2019年科隆古董古物艺术品交易展览会 Phenol
Phenol 2023深圳国际医疗器械展览会
2023深圳国际医疗器械展览会 2024深圳国际智能家居展览会
2024深圳国际智能家居展览会 DowSyn mPAO150
DowSyn mPAO150 自助售药机
自助售药机 TWO-PIECE TOILET ZT-7013
TWO-PIECE TOILET ZT-7013 山东大健康产业展|2025年中国(山东)国际大健康产业博览会
山东大健康产业展|2025年中国(山东)国际大健康产业博览会 2024第十二届(上海)流体机械展览会
2024第十二届(上海)流体机械展览会 意大利里米尼城市介绍
意大利里米尼城市介绍 纽伦堡 - 玩具都城
纽伦堡 - 玩具都城 慕尼黑 - 伊萨尔河畔的酒都
慕尼黑 - 伊萨尔河畔的酒都 法兰克福 - 欧洲金融中心
法兰克福 - 欧洲金融中心 迪拜 - Dubal
迪拜 - Dubal 俄罗斯 - 战斗民族和套娃的国家
俄罗斯 - 战斗民族和套娃的国家 葡萄牙 - 软木塞之乡
葡萄牙 - 软木塞之乡 西班牙 - 斗牛士的故乡
西班牙 - 斗牛士的故乡





