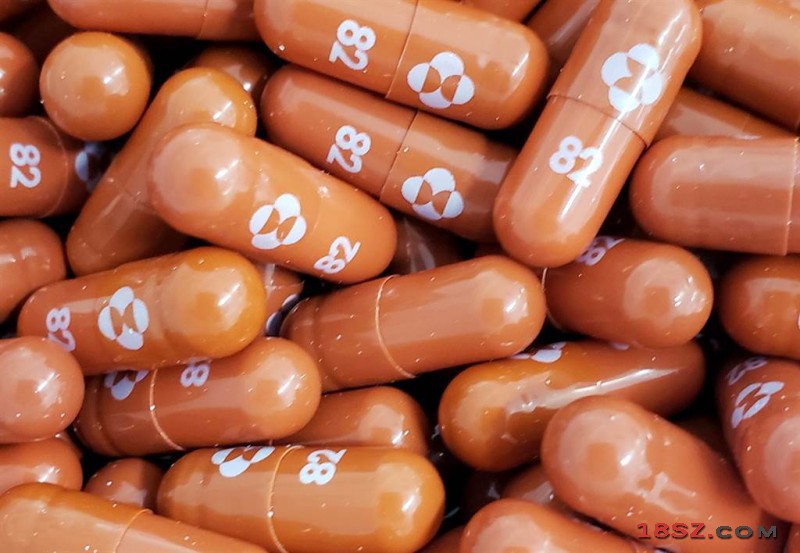
Molnupiravir是美国默克公司和里奇巴克生物医药公司联合研发的口服抗新冠药物,其三期临床试验中期分析数据显示,这款口服药可将轻中症新冠患者的住院或死亡风险降低约50%。(路透社)
(早报讯)欧洲药品管理局考虑对美国默克公司研发的口服抗新冠药物Molnupiravir进行快速审批。

新华社报道,欧洲药管局疫苗部门负责人卡瓦列里周二(5日)在记者会上说,欧洲药管局的咨询委员会将在接下来几天考虑启动程序,快速审批Molnupiravir,并将评估现有相关数据能否支持这种快速审批程序。

默克公司10月1日公布了其与合作伙伴里奇巴克生物医药公司(Ridgeback Biotherapeutics)联合研发的Molnupiravir三期临床试验中期分析数据,其结果显示该药物可将轻中症新冠患者的住院或死亡风险降低约50%。
默克公司发表公告说,由于成果积极,基于独立数据监测委员会建议和与美国食品与药物管理局(FDA)的沟通,已提前终止三期临床试验,并计划尽快向美国药管局提交紧急使用授权申请,也将尽快向全球其他国家和地区的监管机构提交上市申请。

默克上海分公司
卡瓦列里在记者会上还说,截至目前,至少已有10个欧盟成员国决定给本国国民接种新冠疫苗追加剂。
欧洲药管局10月4日宣布,支持18岁及以上群体接种辉瑞-BioNTech新冠疫苗追加剂,同时建议免疫系统受损人群在完成两剂新冠疫苗接种至少28天后再接种一剂辉瑞或莫德纳疫苗追加剂。

 Iteca Exhibitions
Iteca Exhibitions 长城润滑油
长城润滑油 German Machine Tool Builders Association
German Machine Tool Builders Association 延长石油
延长石油 3M制造业
3M制造业 陕煤化工集团
陕煤化工集团 HUAWEI
HUAWEI Dahua Technology
Dahua Technology 中国石油
中国石油 Gemtique
Gemtique KUNVII
KUNVII IAA Show
IAA Show PALEXPO
PALEXPO LASTON
LASTON 中杭贸易
中杭贸易 Etek Europe
Etek Europe PV EXPO
PV EXPO 陕西有色金属
陕西有色金属 QIIE青岛进博会
QIIE青岛进博会 维远光伏产业
维远光伏产业 Time Out Group
Time Out Group IFEMA
IFEMA 天元化工
天元化工 National Media
National Media 吉祥星科技
吉祥星科技 Dowpol Chemical
Dowpol Chemical 海康威视-HIK VISION
海康威视-HIK VISION Hannover Messe
Hannover Messe TOSHIBA
TOSHIBA Productronica
Productronica HealthCare
HealthCare 深圳会展中心
深圳会展中心 大唐旗舰店
大唐旗舰店 Soul Game
Soul Game 神木职教中心
神木职教中心 Sinopec
Sinopec 崔文僮首场旗袍直播秀
崔文僮首场旗袍直播秀 一首歌一座城·江苏无锡《太湖美》
一首歌一座城·江苏无锡《太湖美》 2019年美国康涅狄格国际视频游戏展览会
2019年美国康涅狄格国际视频游戏展览会 中航工业直升机:新生活 新高度
中航工业直升机:新生活 新高度 法称或就美关税威胁向世贸组织申诉
法称或就美关税威胁向世贸组织申诉 圆明园罹难160周年 90秒看科技复原的圆明园
圆明园罹难160周年 90秒看科技复原的圆明园 非物质文化遗产展示——福聚号陶艺
非物质文化遗产展示——福聚号陶艺 70秒回看高交会 通往未来之路
70秒回看高交会 通往未来之路 欧洲央行官员呼吁加强非银行金融部门监管
欧洲央行官员呼吁加强非银行金融部门监管 北京2022官方特许商品零售店玲珑塔店正式开业
北京2022官方特许商品零售店玲珑塔店正式开业 纯天然翡翠平安扣
纯天然翡翠平安扣 洛阳唐三彩:沉睡千年,一朝出土惊世人
洛阳唐三彩:沉睡千年,一朝出土惊世人 Elle Cook——全美青年选美冠军
Elle Cook——全美青年选美冠军 安徽祁门红茶生产基地
安徽祁门红茶生产基地 崔文僮天工精制珠宝大赛作品展
崔文僮天工精制珠宝大赛作品展 中国人民银行发行2021版熊猫金银纪念币一套12枚
中国人民银行发行2021版熊猫金银纪念币一套12枚 2024第十届上海国际智慧工地展览会
2024第十届上海国际智慧工地展览会 2023年阿联酋迪拜户外用品及休闲用品展览会
2023年阿联酋迪拜户外用品及休闲用品展览会 2025年西班牙MWC展台搭建@2025MWC通信展
2025年西班牙MWC展台搭建@2025MWC通信展 2024年英国伯明翰电子烟展览会
2024年英国伯明翰电子烟展览会 Novel Coronavirus IgG/IgM
Novel Coronavirus IgG/IgM 宁波家用电器展|2025年中国国际电子消费品及家用电器博览会
宁波家用电器展|2025年中国国际电子消费品及家用电器博览会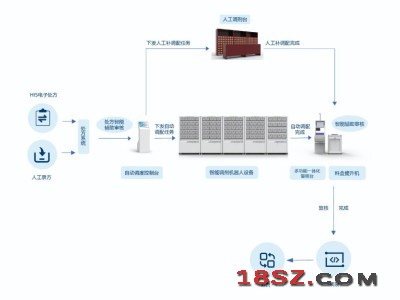 中药饮片调剂自动化解决方案
中药饮片调剂自动化解决方案 2023年美国盐湖城户外用品及运动用品展览会
2023年美国盐湖城户外用品及运动用品展览会 意大利里米尼城市介绍
意大利里米尼城市介绍 纽伦堡 - 玩具都城
纽伦堡 - 玩具都城 慕尼黑 - 伊萨尔河畔的酒都
慕尼黑 - 伊萨尔河畔的酒都 法兰克福 - 欧洲金融中心
法兰克福 - 欧洲金融中心 迪拜 - Dubal
迪拜 - Dubal 俄罗斯 - 战斗民族和套娃的国家
俄罗斯 - 战斗民族和套娃的国家 葡萄牙 - 软木塞之乡
葡萄牙 - 软木塞之乡 西班牙 - 斗牛士的故乡
西班牙 - 斗牛士的故乡





